AGEUM - Analytiktechnikum für Gesundheits- und Umweltforschung
Forschung aktuell



Ziel des Vorhabens
Das Analytiktechnikum für Gesundheits- und Umweltforschung (AGEUM) ergänzt die skalenübergreifende und multimodale Analytik des IKTS-Standorts Forchheim um dedizierte Modalitäten im Bereich Gesundheitsforschung jenseits der reinen Charakterisierung von fixierten und eingebetteten Geweben hin zu funktionsbeschreibender Analytik, ex-vivo und in-vivo. Hierbei wird die gesamte Wertschöpfungskette abgebildet, inklusive Probenvorbereitung, Charakterisierung und Datenauswertung. Die strategischen Investitionen beinhalten:
1) Aufbereitung bio-medizinischer Proben für die multimodale und skalenübergreifende Charakterisierung
- Biolaborausstattung für die gezielte Aufbereitung bio-medizinischer Proben (S2-Standard), um Zellkulturen anwachsen und langfristig lagern zu können
- Kryo-Workflow mit Hochdruckgefrierer und Gefriersubstitution zur Vitrifikation und Einbettung der biologischen Probensysteme, ohne die fragilen Strukturen zu verändern
2) Multimodale und skalenübergreifende Charakterisierung
- Vollintegrierte konfokale Mikroskop Plattform für Hochdurchsatz molekulares Fingerprinting und labelfreie chemische Bildgebung
- Rasterelektronenmikroskopie (REM) mit höchstauflösender Operando- Röntgenanalytik (XRM II Technologie) zur 2D Oberflächen und 3D Volumenanalyse inklusive weiterführender Analytik (Kathodolumineszenz, EDX)
- Infrarot-Spektrometer (Abb. 1) mit durchstimmbaren Infrarot-Quantenkaskadenlaser zur hyperspektralen chemischen Bildgebung in- und ex-situ
- Röntgenfluoreszenzanalysator (Abb. 2) zur zerstörungsfreien Elementanalyse
3) Korrelative Datenanalyse und vereinheitlichtes Datenmanagement
- High-performance Cluster für hochverfügbare Datenspeicherung und -analyse
- Korrelative Datenplattform ‚XF-Health‘ zur FAIRen Datenverarbeitung und bereitstellung
Der spezialisierte Workflow ermöglicht es Zellen und Gewebeproben und deren Interaktion mit unterschiedlichsten Materialien zum Beispiel solche denen Umweltverschmutzungsrelevanz (z.B. Feinstaub, Nanoplastik) zugesprochen wird, mithilfe moderner, hochaufgelöster und ultraschneller Licht-, Elektronen- und Röntgenmikroskopie ex- und in-vivo betrachtet zu betrachten. Die biologische Aktivität kann zu definierten Interaktions-/Entwicklungszeitpunkten schlagartig gestoppt werden, um diese „Momentaufnahme“ post-mortem im skalenübergreifenden, multimodalen Detail mit der in Forchheim bereitstehenden Analytik weiter zu analysieren. Die erzeugten großen, zu korrelierenden, heterogenen Datensätze werden im Anschluss automatisch, statistisch und quantitativ ausgewertet und FAIR bereitsgestellt. Die ‚XF-Health‘ Datenplattform ermöglicht es dabei Methoden des maschinellen Lernens vermehrt für bio-medizinische Fragestellungen etablieren zu können.
Anwendungsbeispiel der vollintegrierten konfokalen Mikroskop Plattform
Die vollintegrierte konfokale Mikroskop Plattform (Abb. 3) vereint eine Vielzahl an komplementären Messmodalitäten miteinander:
- Laser Scanning Microscopy (LSM)
- Fluorescence Lifetime Imaging Microscopy (FLIM)
- Stimulated Raman Scattering (SRS)
- Coherent Anti-Stokes Raman Scattering (CARS)
- Second Harmonic Generation (SHG)
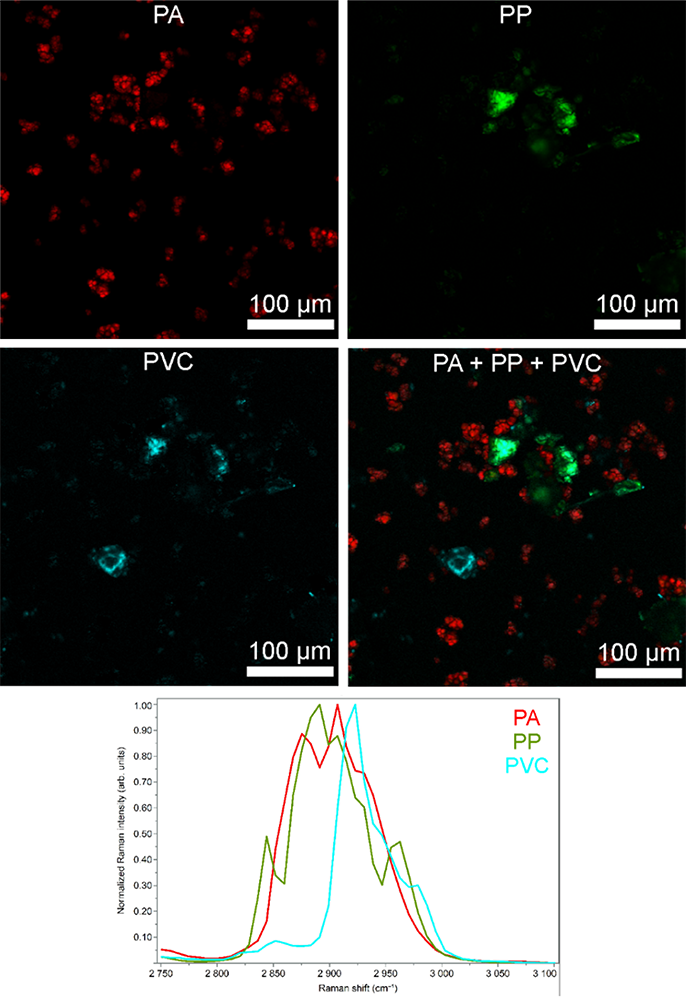
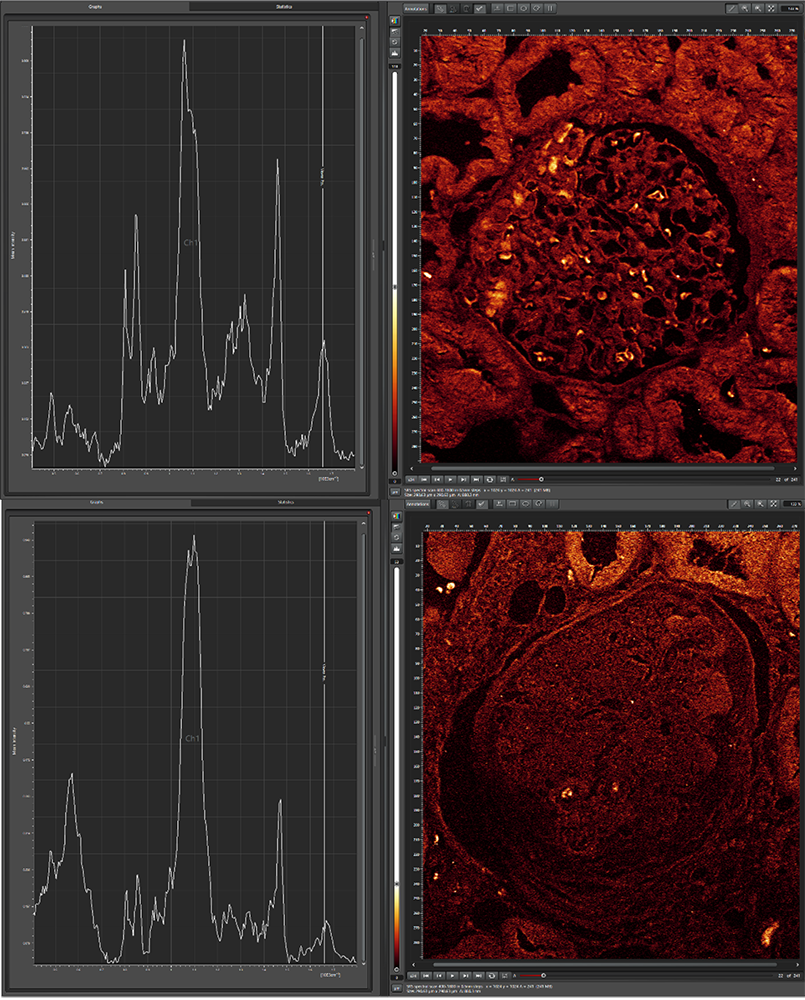
Eine Inkubationskammer ermöglicht dabei neben ex-vivo Experimenten auch die Beobachtung lebender Zellen. Dabei kann zum Beispiel, ohne die Notwendigkeit mit einem Fluorophor zu markieren, zwischen Gewebe und Partikeln unterschieden werden, um z.B. Mikroplastikbelastungen in Organen zu bestimmen. Verschiedene Plastikarten können dabei auch unterschieden und zugeordnet werden, was Aufschluss über die Herkunft der Partikel gibt. Aber auch markierte Proben können untersucht und z.B. spektral überlappend emittierende Fluorophore durch FLIM unterschieden werden. In Geweben werden des Weiteren durch Krankheiten detektierbare chemische Veränderungen induziert (Abb. 5) die Aufschluss über die Krankheit selbst und mögliche Medikamentierungen geben können.
Das Vorhaben wird gefördert durch die Europäische Union (EFRE-Förderung REACT-EU ROF-SG20-3066-2-9-8).