Effiziente Stoff- und Energiewandlung durch Verknüpfung von Stofftrennung und Reaktion im Membranreaktor
Hintergrund
Die Stofftrennung wird heute der chemischen Synthese nachgeschaltet und ist in der Regel zeit- und energieaufwendiger als die Synthese selbst. Bei den Stofftrennverfahren in der Chemie dominieren thermische Verfahren wie die Destillation, Extraktion oder Adsorption.
Membrantrennverfahren sind energetisch deutlich günstiger als thermische Trennverfahren. Auf Grund der chemischen und thermischen Stabilität keramischer Materialien sollte es möglich sein, die Membranen direkt im Reaktor einzusetzen und damit chemische Reaktion und Stofftrennung zu koppeln. Die Membran kann dabei zur Dosierung von Ausgangsstoffen oder zur Abtrennung von Produkten oder Nebenprodukten eingesetzt werden, um die Lage des chemischen Gleichgewichts zu verschieben und damit die Ausbeute zu erhöhen. Sie kann selbst katalytisch aktiv sein oder mit einem Katalysator beschichtet werden. Damit wird es möglich, reaktive Zwischenprodukte zu isolieren und bei gleichgewichtslimitierten Reaktionen höhere Ausbeuten zu erreichen.
Durch die Kopplung einer katalysierten chemischen Reaktion mit einer Membran, die je nach Bedarf Edukt-dosierend oder Produkt-abziehend eingesetzt werden kann, können chemische Stoffsynthesen wesentlich effizienter gestaltet werden. Dieses Prinzip ist bereits seit längerer Zeit bekannt, in der Industrie bisher jedoch noch nicht etabliert. Durch den Einsatz von Membranreaktoren für chemische Stoffsynthesen lassen sich neue Reaktor- und Anlagenkonzepte entwickeln. Die Kombination des Katalysators mit der Membran kann auf verschiedene Weisen realisiert werden:
- Loser Kontakt zwischen Membran und einem Katalysatorfestbett oder Monolith
- Membran fungiert als Träger für den Katalysator (Beschichtung)
- Katalytisch aktive Membran
Die Trennrichtung der Membran richtet sich dabei nach den Anforderungen des Prozesses.
Beispiel 1): Membranreaktoren für chemische Stoffsynthesen: Power-to-Gas PtG / Power-to-Liquid PtL
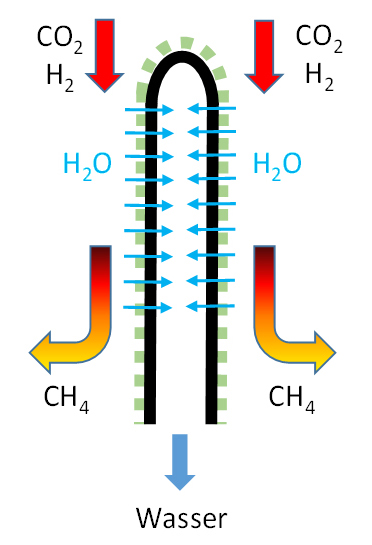
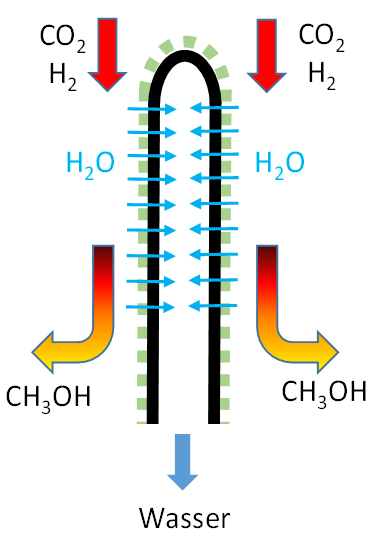
Bei chemischen Stoffsynthesen mit Gleichgewichtslimitierung kommt der Membran die Aufgabe zu, ein Produkt selektiv zu entfernen, dadurch den Umsatz zu erhöhen und ein aufgereinigtes Produkt zu erhalten. Beispiele für solche Reaktionen stellen die Methanisierung (Power-To-Gas: PtG) und die Methanolsynthese (Power-To-Liquid: PtL) unter Nutzung von Kohlenstoffdioxid (CO2) und Wasserstoff (H2) als Edukte dar, da bei beiden als entfernbares Reaktionsprodukt Wasser entsteht.
Der Sabatierprozess zur Herstellung von Methan (CH4) aus dem Abfallstoff CO2 und aus Wasserstoff (H2) erregt zurzeit großes Interesse in Bezug auf die Herstellung von „künstlichem Erdgas“ für die Energiespeicherung. Auf Basis dieses Prozesses kann über den Weg „Power-to-Gas“ (PtG) regenerativer Überschussstrom über die Zwischenstufe Wasserstoff in speicherbares Methan gewandelt werden. Dabei ist die Effizienz des Verfahrens von entscheidender Bedeutung für die Wirtschaftlichkeit. Ein Ansatzpunkt zur Effizienzerhöhung ist die Aufhebung der Gleichgewichtslimitierung der Reaktion, um über geeignete Maßnahmen höhere Stoffumsätze und Methanausbeuten zu erzielen. Nach dem Prinzip von Le-Chatelier (Prinzip vom kleinsten Zwang) kann die Lage des chemischen Gleichgewichts durch das Verhältnis der beteiligten Reaktanden zueinander in weiten Grenzen verschoben werden. Hierbei wird idealerweise das Wasser als Reaktionsprodukt entfernt, um hochkonzentriertes Methan zu erhalten. Für diese Trennaufgabe sind Membranen mit spezifischer Selektivität für Wasser(dampf) unter Zurückhaltung der weiteren Komponenten H2, CO2 und CH4 besonders geeignet. Sinnvoll wird die Reaktion bei hohem Druck ausgeführt (z.B. H2 aus der Hochdruckelektrolyse). Bei Verwendung eines Membranreaktors verbleibt Methan auf der Hochdruckseite und muss gegebenen-falls für eine Einspeisung ins Erdgasnetz nicht komprimiert werden.